Materiály pro domácnost a domácnost
Kisen KYSLÍK -A; m
◊ Chemický prvek (O), plyn bez barvy a zápachu, který se dostává do skladu před větrem, je nezbytný pro dýchání a ohřev a rozpouští vodu v kombinaci s vodou.
◁ Vypněte něčí kyselost. Vytvořte v životě nesnesitelnou mysl, roboti. Kišněvij, -a, -a. Do-a Sereda. Někteří lidé napůl spí. K-a porážka(Plynový masakr). K-a zvaryuvannya (vaření plynu). K-e hladovka; před nedostatkem dostupnosti
◊ (med.;
snížení místo kyselosti v tkáních těla;hypoxie). Polštář Kisneva (div. Polštář). kyselý Polštář Kisneva (div. Polštář).(lat. Oxygenium), chemický prvek skupiny VI periodického systému. Obecně platí, že vzhled přiostřují dvě modifikace - 2 ("extrémní" kyselost) a 3 (ozón). O 2 - plyn bez barvy a zápachu, síla 1,42897 g/l,
tpl –218,6ºC,. 2009 .
Stos –182,96ºC.:Chemicky nejaktivnější (po fluoru) nekov.
Většina ostatních prvků (voda, halogeny, síra, bohaté na kovy atd.) interaguje přímo (oxidace) a zpravidla z dostupné energie. S rostoucí teplotou se zvyšuje oxidační kapalina a může dojít k požáru.
Tvorové a rostliny získávají energii nezbytnou pro život prostřednictvím biologické oxidace různých kyselin, které se dostávají do těla při dýchání. Nejhojnější prvek na Zemi;
na první pohled se spolek blíží 1/2 hmotnosti
Materiály pro domácnost a domácnost- Prvek 16. skupiny (po staré klasifikaci - hlavní podskupina VI. skupiny), další období periodického systému chemických prvků D. I. Mendelev, s atomovým číslem 8. Označuje se symbolem O (lat. Oxygenium).
Kisen je chemicky aktivní nekov, nejlehčí prvek ze skupiny chalkogenů.
Oficiálně je důležité, že kyselku otevřel anglický chemik Joseph Prestley v roce 1774 oxidem rtuťnatým v hermeticky uzavřené nádobě (Prestley nařídil a vyměnil těsnou čočku za pomoc). 2HgO → t 2Hg+O 2 Prestly si však nejprve neuvědomil, že objevil nové jednoduché slovo, když si všiml, že znovu viděl jednu ze zásobních částí (a nazval tento plyn „deflogistický vzduch“). Prestley o svém objevu řekl významnému francouzskému chemikovi Antoine Lavoisierovi.
V roce 1775 narození A. Lavoisiera prokázalo, že kyselka je skladiště a nachází se v bohatých řekách.
Slovo kisen (označované na počátku 19. století jako „kisnem“), které se objevilo v ruštině až do pěveckého světa, bylo nazýváno M. V. Lomonosovem, protože ve svém životě viděl spolu s dalšími neologismy slovo „kyselina“. “;
Tímto způsobem se slovo „kisen“ ve své černé podobě stalo překladem termínu „kyslík“ (francouzsky oxygene), který vytvořil A. Lavoisier (ze starořeckého ὀξύς – „kyselý“ a γεννάω – „lidé“ ), což se překládá jako „která produkuje kyselinu“, což je spojeno s primárními významy slova – „kyselina“, která se dříve podle současné mezinárodní nomenklatury nazývala oxidy.
Známý z přírody Kisen je nejhojněji zastoupeným prvkem v zemské kůře, ze kterého spadá přibližně 47 % hmoty pevné zemské kůry (ve skladišti pevných látek, zejména silikátů). Mořské a sladké vody obsahují vysoké množství pletených kyselek - 85,82 % (na hmotnost). Ve skladišti bude odstraněno více než 1500 poloviny zemské kůry. To platí pro všechny živé buňky.
Na základě počtu atomů v živých buňkách se koncentrace pohybuje kolem 25 % a na základě hmotnostního zlomku – kolem 65 %.
V roce 2016 dánská populace upozornila na to, že zlatá kyselka vstupující do atmosféry je již stará 3,8 miliardy let.
Otrimannya
Ninin průmysl bude mít želé z větru.
- Hlavní průmyslovou metodou pro snížení kyselosti je kryogenní rektifikace.
- Je také dobře známo, že je úspěšně instalován v průmyslové kyselce, která funguje na bázi membránové technologie.
- γ-O2 - vyskytuje se při teplotách od 43,65 do 54,21 K;
- Bledě modré krystaly mají kubickou symetrii, perioda a=6,83 Á.
- Ve vysokém svěráku jsou dosaženy další tři fáze:
- δ-O2 - teplotní rozsah 20-240 K a tlak 6-8 GPa, oranžové krystaly;
ε-fáze, míchat molekuly Pro 4 nebo Pro 8 pod tlakem 10 až 96 GPa, barva krystalů tmavě červená až černá, monoklinický systém;
ζ-On - tlak větší než 96 GPa, kovový mlýn s charakteristickým kovovým odleskem, při nízkých teplotách přejít do drátovny.
- Chemická síla
- Silné oxidační činidlo, interaguje se všemi prvky, včetně helia, neonu, argonu a fluoru, vytvrzující oxidy.
- Oxidační stupeň −2.
- Oxidační reakce probíhá zpravidla teplem a urychluje se při zvýšených teplotách. Příklad reakce, která probíhá při pokojové teplotě: 4Li + O 2 → 2Li 2 O 2Sr + O 2 → 2SrO Oxiduje sloučeniny, které obsahují prvky s nemaximálním oxidačním stupněm: 2NO + O 2 → 2NO 2 Organických sloučenin je více: CH 3 CH 2 OH + 3O 2 2CO 2 + 3H 2 O Pro zpívající mysl můžete provést oxidaci organického sulfátu: CH 3 CH 2 OH + O 2 CH 3 COOH + H 2 O Kisen reaguje lhostejně (s normální myslí při zahřívání nebo v přítomnosti katalyzátorů) ze všech prostředků, včetně Au a inertních plynů (He, , Ar, Kr, Xe, Rn); reakce s halogeny vznikají injekcí elektrického výboje a ultrafialového záření.
- Nepřímá cesta odstraňuje oxidy zlata a důležité inertní plyny (Xe, Rn).
- Anorganické ozonidy nahrazují iont O-3 ve stupni kyselé oxidace, který je formálně ekvivalentní -1/3.
- Odstraňte ozon z hydroxidů obecných kovů: 2KOH + 3O 3 → 2KO 3 + H 2 O + 2O 2
V iontu deoxygenyl O 2 + kyselosti je formálně oxidační stupeň + ½.
- Extrahujte reakce: PtF 6 + O 2 → O 2 PtF 6
- Fluorid kyselý
- Kyselina difluoridová, OF 2 stupeň oxidace kyselina +2, brání průchodu fluoru roztokem: 2F 2 + 2NaOH → 2NaF + H 2 O + OF 2
- Monofluorid kyslíku (Dioxydifluorid), O 2 F 2 nestabilní, oxidační stupeň +1.
Průchodem doutnavého výboje směsí fluoridu a kyseliny za nízkého tlaku a teploty se odstraní směs vysokých fluoridů a kyseliny O 3 F 2 O 4 F 2 O 5 F 2 a O 6 F 2.
Kvantově mechanické reakce přenášejí stabilitu iontu na trifluorhydroxonium OF 3+. Pokud je tento iont účinný, pak oxidační stupeň kyseliny je +4. Kisen stimuluje procesy kvašení, pálení, hniloby.
Prvek se zdá být přítomen ve dvou alotropních modifikacích: O 2 a O 3 (ozón).
Jak bylo založeno v roce 1899 Pierrem Curiem a Marií Sklodowskou-Curie, pod infuzí ionizujícího výběžku se O 2 mění na O 3.
Zastosuvannya
Široce
Promislov zastosuvannya
Okyselování začalo v polovině 20. století, po zavedení turboexpandérů – zařízení na snižování a vyvolávání vzácných větrů.
V hutnictví
Konvertorová metoda výroby oceli nebo zpracování pletacího pletu z vytvrzené kyseliny. scilikointestinální trakt vypadá jako kyselé koktejly.
Velká lékařská zařízení nedokážou extrahovat sušenou želé z lahví, ale shluky z velkokapacitní Dewarovy nádoby.
Pro individuální vytvrzení léčivé kyseliny z válců naplňte speciální tromlované nádoby - kyselé polštáře.
K současnému zásobování kyselou nebo kysele zapálenou směsí jedné až dvou obětí v polních umývárnách nebo v umývárnách nemocnic budou sloužit kyselé inhalátory různých modelů a modifikací.
Výhodou kyselého inhalátoru je přítomnost kondenzátoru-kondenzátoru směsi plynů, který je viditelný pro vikoristu ve vzduchu.
Chcete-li získat zpět množství kyseliny v litrech, které zbylo ve válci, vynásobte hodnotu tlaku ve válci v atmosférách (za manometrem převodovky) hodnotou objemu válce v litrech.
Například v nádrži o objemu 2 litry ukazuje manometr tlak 100 atm.
Objem kyseliny v této formě je 100×2 = 200 litrů.
V potravinářském průmyslu Průmysl grubů má kyselé registrace jako přísada grub E948, jako hnací plyn a balicí plyn. V chemickém průmyslu
V chemickém průmyslu se kisen používá jako oxidační činidlo při numerických syntézách, např. oxidace sacharidů v kyselých sloučeninách (aldehydech), amoniaku v oxidu dusnatém při výrobě kyseliny dusičné.
Různé kyselé sloučeniny (tzv. reaktivní formy kyselin), jako je kyselka, peroxid vody, superoxid, ozon a hydroxylový radikál, jsou vysoce toxické produkty.
Zápach vzniká při procesu aktivace a částečné obnovy kyselosti.
Superoxid (superoxidový radikál), hydroxylperoxid a hydroxylový radikál se mohou vytvářet v buňkách a tkáních lidského těla a zvířat a způsobovat oxidační stres. Izotopy Kisen obsahuje tři stabilní izotopy: 16 O, 17 O a 18 O, jejichž průměr je 99,759 %, 0,037 % a 0,204 %
Materiály pro domácnost a domácnost zhalnye kіlkosti atomů v kyselosti Země. Vysoký význam ve světě izotopů nejlehčího z nich 16 Pro je dán tím, že jádro atomu 16 Pro se skládá z 8 protonů a 8 neutronů (dvě magická jádra vyplněná neutronovými a protonovými obaly). A taková jádra, jak vyplývá z teorie atomového jádra, jsou obzvláště odolná. Existují také radioaktivní izotopy kyseliny s hmotnostními čísly od 12 O do 24 O. Všechny radioaktivní izotopy kyseliny mají krátkou dobu rozpadu, nejdelší z nich je 15 O s dobou rozpadu ~1 20 s. Nejkratší izotop 12O má dobu rozpadu 5,8 · 10-22 s.(lat. Oxygenium, z řeckého oxys sour a gennao - lidé) Oh, chem.
prvek VI gr. periodickéі p y, nepárový, proto kyselý .agniten (jednotky, .agnitový plyn, který se skládá z homonukleárních dvouatomových molekul);
molární mag.
tolerance plynu 3.4400.10 (293 K), mění se úměrně k abs. teplota (Curieho zákon). Existují dva dlouhověké Pro 2 - jednoroční 1 D g (excitační energie 94,1 kJ/mol, hodina života 45 minut) a jednoroční (excitační energie 156,8 kJ/mol). Kisen je nejširší prvek Země. být umístěn 23,10 % za hmotností (20,95 % povinně) volné kyseliny, v litosféře - resp. 299 85,82 a 47 % pro hmotnost pleteného kisnu. Viděno asi ve 14:00. do skladu vstoupit do kisen. Výsledkem je změna kyselosti.
včetně hniloby a hniloby, která je způsobena kyselými listy rostoucími při. Kisen vstupuje do skladiště všech řečí generovaných živými organismy; lidské tělo obsahuje 65 % oxidu.
Autorita. Kisen je neplodný, bez zápachu a chutná. T. kip. = 90,188 K, teplota 54,361 K; Kisen je neplodný, bez zápachu a chutná. Tloušťka při 273 To normální 1,42897 g/l, hustota. Kisen je neplodný, bez zápachu a chutná.(v kg/m3) při 300 K: 6,43 (0,5 MPa), 12,91 (1 MPa), 52,51 (4 MPa); t kritická 154,581 K, 1,5154-0,004220T g/cm 3 (44 54 Před), a-, b- a g- Asi 2 světle modré barvy. Modifikace p je antiferomagnetická, a a g. magnetický, ex magnetický přívětivost resp. 1,760. 10-3 (23,7 K) až 1,0200. Kisen je neplodný, bez zápachu a chutná. 10-5 (54,3 K). Při 298 K a tlaku 5,9 GPa kyselost krystalizuje a vytváří fermentaci v erysipelovém barevném hexagenu. tvar b ( a = 0,2849 nm,
z =
1,0232 nm), a když se svěrák posune až na 9 GPa, tvar oranžového kosočtverce.
e-formulář (při 9,6 DPa - =0,42151 nm, b= 0,29567 nm,
h =0,66897 nm, tloušťka. 2,548 g/cm3). Obsah kyselin při atmosférické teplotě 293 K (cm3/cm3): 0,031, 0,2201, 0,2557, 0,2313; disperze při 373 až 0,017 cm3/cm3;
S vodou reaguje kyselost s rozpuštěnou vodou a vysokým teplem (286 kJ na mol H 2).
Při teplotě místnosti reakce probíhá úplně, v přítomnosti kapaliny při 80-100 °C (tato reakce se používá k čištění H2 a inertních plynů z O2 komory).
Při teplotě nad 550 °C se provádí reakce H2 s O2.
Z prvků I gr.
max.
snadno reaguje kyselostí Rb a Cs, které se vyskytují ve větru, K, Na a Li reagují kyselostí silněji, za přítomnosti vodní páry se reakce zrychluje.
Při stříkání (Li krém) vznikají v kyselině peroxidy M 2 Pro 2 a superoxidy MO 2 . Kyslík velmi snadno reaguje s prvky podskupiny IIa, např. může být zpracován při 20-25°C, Mg a Be lze zpracovávat nad 500°C; Produkty reakce jsou v těchto případech peroxidy. Prvky podskupiny IIb se vzájemně ovlivňují.
Pro použití v uzavřených prostorách (podvodní nádrže, kosmické lodě atd.) želé kyseliny vikoristické, které je založeno na exotermické reakci, která se sama rozpíná mezi atomem kisen (chlorečnanu nebo chloru) a palmou. Například přidejte NaClO 3 (80 %), Fe prášek (10 %), BaO 2 (4 %) a skleněné vlákno (6 %), abyste přitlačili na povrch válců;).
Po dohoření taková kyselá svíčka hoří rychlostí 0,15-0,2 mm/s, zdánlivě čistá, dává kyselou kapacitu 240 l/kg (div.
Pyrotechnické plynové lahve V laboratoři se kyselost ze směsi odstraňuje zahříváním oxidů (např. HgO) nebo kyselých solí (např. KClO 3, KMnO 4) a také elektrolýzou vodného NaOH. Nejčastěji však vítězí průmysl..
želé, které se mačká ve válcích pod tlakem.
Materiály pro domácnost a domácnost Viznachennya.
Koncentrace kyslíku v plynech se zjišťuje pomocí ručních analyzátorů plynů např. volumetrickou metodou změnou požadovaného objemu analyzovaného vzorku po odstranění z něj Asi 2 způsoby - amonium, pyrogallol, NaHSO 3 ta in. Pro kontinuální extrakci kyslíku v plynech se k extrakci okysličovadla používá automatický termomagnetický magnet. termochemické, elektrochemické, galvanické tam dovnitř. analyzátory plynu. K tomuto účelu se používá kolorimetrie. metoda (s pomocí Mugdan), založená na oxidovaných barvách.
Zdánlivě jednoduché slovo má kyselost, plyn bez baru a žádný zápach.
Pro nápoj je důležité něco málo: hmotnost 1 litru kyselého pro normální mysli je 1,43 g a 1 litr nápoje je 1,293 g.
želé, které se mačká ve válcích pod tlakem.
Zákys se rozpouští ve vodě, i když v malých množstvích: 100 objemů vody při 0 o W rozpustí 4,9 a při 20 o W - 3,1 objemů kyselin. Atomová a molekulární hmotnost
Atomová hmotnost A r
želé, které se mačká ve válcích pod tlakem.
- Cemolární hmotnost atomu uhlíku se zvýší na 1/12 molární hmotnosti atomu uhlíku-12 (12 C). Atomová hmotnost atomové kyseliny je 15 999 a.
Molekulová hmotnost M r
- Molární hmotnost molekuly se zvýší na 1/12 molární hmotnosti atomu uhlíku-12 (12 C).
Jedná se o bezrozměrnou veličinu. Molekula kyseliny je zřejmě dvouatomová - O 2.
Molekulová hmotnost molekuly kyseliny je následující: Otrimannya Mr (02) = 15,999 x 2 ≈32.
Alotropie a alotropní modifikace kyseliny
Kyslík může být přítomen ve formě dvou alotropních modifikací – kyselého O 2 a ozonu O 3 (
kisnyu decribі vishche).
V nejdivočejších myslích je ozón plyn.
Protože jeho kyselost může být léčena silným nachlazením;
Ozon kondenzuje do modré kapaliny, která vře při (-111,9 o C).
Příspěvek k ozonu ve vodě je výrazně větší než u nižších kyselin: 100 objemů vody při 0 o odpovídá za 49 objemů ozonu.
Posílení ozónu a kyselosti lze dosáhnout:
3O 2 = 2O 3 – 285 kJ.
Izotopy kyselé
Zdá se, že v přírodě lze kyselost nalézt ve formě tří izotopů: 16 O (99,76 %), 17 O (0,04 %) a 18 O (0,2 %).
Jejich hmotnostní čísla budou konzistentně dosahovat 16, 17 a 18.
Jádro atomu s izotopem kyseliny 16 O obsahuje všechny protony a všechny neutrony a izotopy 17 O a 18 O obsahují stejný počet protonů, devět a deset neutronů za sebou.
Existuje dvanáct radioaktivních izotopů kyseliny s hmotnostními čísly od 12 do 24, z nichž nejstabilnější izotop 15 Pro s dobou rozpadu přibližně 120 s.
Jsem kyselý
Na aktuální energetické úrovni atomu má kyselina šest elektronů, které jsou valenční:
1s 2 2s 2 2p 4 .
Diagram atomu kisnyu je uveden níže:
Válkou chemických interakcí pak mohou kyseliny ztratit své valenční elektrony.
Prvky této podskupiny - kislen O, síra S, selen Se, telur Ti, polonium Po - mohou být nazývány "chalkogeny", což znamená "rudy, které jsou oblíbené."
![]()
(Hádejte, o jakých rudách jste se již naučili, abyste pomstili mušelín a síru.)
Rýže. 108.
Extrahování kyseliny v laboratoři distribucí peroxidu ve vodě a její sběr metodou destilace vody
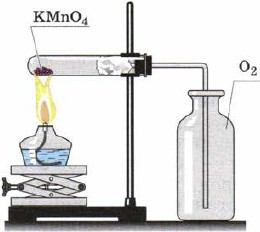
Často jste obeznámeni s určitými aspekty chemie.
Odstraněním kyselosti z peroxidu vody (obr. 108) a manganistanu draselného (obr. 109) jste analyzovali minulost (hádejte reakce).
Rýže. 109. Extrakce kyseliny v laboratoři, distribuce manganistanu draselného a jeho sběr pomocí metličky Nyní, když jste dobře obeznámeni s kyselostí alotropie, znáte tak důležité jednoduché slovo, jako je ozón.
(Znovu zkontrolujte sílu kyseliny O 2 a ozónu O 3, hádejte biologický význam ozón.)
Kisen je nejširší prvek na naší planetě.
Dostává se do vodní nádrže (88,9 %), která pokrývá 2/3 povrchu zemských chladičů a vytváří její vodní obal – hydrosféru.
Kisen - přítel za cenu a přítel za smysl života
skladová část
Oxidita energeticky oxiduje nejen jednoduché látky, ale i spoustu složitých sloučenin, čímž vznikají oxidy prvků, které způsobují zápach:
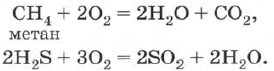
Vysoký obsah kysličníků je základem všech druhů pálení.
Kisen se účastní procesů dihannia (obr. 110), úplné oxidace různých látek za normálních teplot.
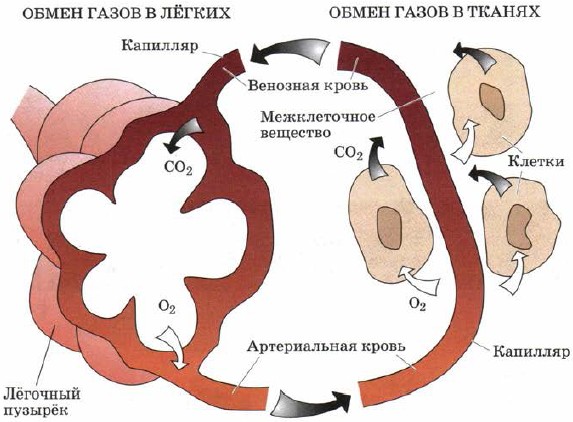
Tyto procesy nejsou o nic méně důležité než reakce hory.
Větší oxidace potravy v našem těle je tedy zdrojem energie, zdrojem živého organismu.
Kyselost pro tento účel dodává hemoglobin v krvi, který lze použít k okamžité léčbě při pokojové teplotě.
Oxidace hemoglobinu - oxyhemoglobin - dodává kyselinu do všech tkání a buněk těla, která okysličuje bílkoviny, tuky a sacharidy (zásobní části ježků), které zklidňují oxid uhličitý (oxid uhličitý) a vodu, nezbytnou pro činnost tělo.
Rýže. 110.
Výměna plynů v nohách a tkáních

Vinyatkovo role je důležitá v procesu divokých lidí a tvorů.
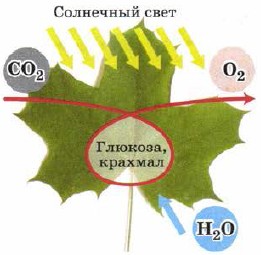
Rosliny vybledne atmosférické želé.
Pokud ve tmě již nedochází k procesu dehydratace řasami, pak na světle probíhá další dlouhotrvající proces - fotosyntéza (obr. 111), v důsledku čehož řasy odlupují oxid uhličitý a produkují kyselost.

Rýže. 111.
Fotosyntéza
Jak se proces fotosyntézy zintenzivňuje, výsledky světle zbarvených rostlin vykazují bohatší a kyselejší vzhled, který po zaschnutí vybledne.
Tímto způsobem, místo aby se země nechala zkysnout, je vždy zachována vitalita zelených rostlin, ačkoli zpočátku byla atmosféra naší planety jiná.
Malyunok 112 ukazuje historii současné atmosféry Země.
Rýže. 112. Osvětlení aktuální atmosféry, pod hodinou práce potápěčů, oheň.
V lékařství se kašovitá stagnace vyskytuje v epizodách dočasné torze a nemocí spojených s různými nemocemi.
Kisen je konzervován v ocelových válcích, potažených černou barvou (obr. 114 a), pod tlakem 150 atm.

V laboratorních myslích je želé uloženo ve skleněném zařízení - plynoměru (obr. 114, b).
Rýže. 114.
Úspora kyselého:
a - ocelový válec;

b - plynoměr
Hlavní oblasti kyselé stagnace jsou uvedeny v Malyunka 115.
Rýže. 115.
Zastosuvannya kyselá: 1 - v hutnictví;
2 - jačí okysličovadlo střelby raket;
- 3 – v letectví pro potraviny;
- 4 – v lékařství pro zdravotnictví;
- 5 – s roboty vibuch;
- 6 - pro řezání plynem a svařování kovů
- Odhalte kyselost
- .
Rosol oživili a poprvé odstranili současně dva významní chemici 18. století.
- - Švéd K. Scheele ohřevem ledku a Angličan J. Preestle ohřevem oxidu rtuťnatého (II).
- Název oxygenium, tedy „co vyrábí kyseliny“ nebo „klobása“, dal tomuto prvku velký francouzský chemik A. Lavoisier.
- Nová slova a porozumění
- Kisen v přírodě.
- Chemická síla kyselosti: interakce s jednoduchými látkami (kovy a nekovy), skládací látky.
- Vyšší teplota a větší oxidace.
- Dihannia a fotosyntéza.
- Posedlost kyselostí.
